Ein Polyhistidin-Tag (synonym His-Tag, Hexahistidin-Tag, His6-Tag) ist ein Protein-Tag, das zur Proteinreinigung und zum Nachweis markierter Proteine verwendet wird.
Eigenschaften
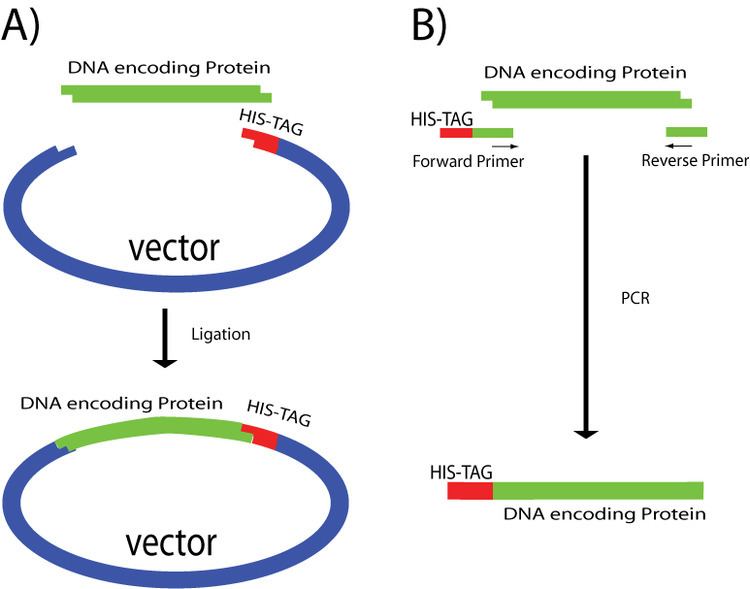
Die Aminosäuresequenz des Polyhistidin-Tags ist eine Folge von mindestens sechs Histidinen, deren Gensequenz N-terminal nach dem Start-Methionin-Codon oder C-terminal vor das Stopcodon in das offene Leseraster eines Gens kloniert wird. Dadurch entsteht ein Fusionsprotein mit einem Polyhistidin-Tag. Gelegentlich wird eine Schnittstelle für eine Protease oder ein Intein zwischen Protein und Polyhistidin-Tag eingefügt, um eine Abspaltung des Tags nach einer Proteinreinigung zu ermöglichen.
Das Polyhistidin-Tag bindet mit mikromolarer Affinität an zweiwertige Nickel- oder Cobalt-Ionen und bildet einen Chelatkomplex. Werden die Ionen durch Bindung an einen Feststoff-gekoppelten Chelator immobilisiert, können die Proteine mit Polyhistidin-Tag in einer Affinitätschromatographie (genauer: in einer Metall-Chelat-Affinitätschromatographie) selektiv gebunden werden und durch Spülen der Säule mit 20 mM Imidazol von den ungebundenen Proteinen befreit werden. Ernst Hochuli koppelte 1987 den NTA-Liganden an Agarose-Kügelchen um Proteine damit aufzureinigen. Diese Agarose wird als Säulenbett wird meistens Nitrilotriessigsäure-Agarose (Ni-NTA-Agarose), seltener auch Ni2 -Iminodiessigsäure-Agarose (Ni-IDA-Agarose) oder Co2 -Carboxymethylaspartate-Agarose (Co-CMA-Agarose) verwendet. Die Elution der gebundenen Proteine erfolgt mit einem Puffer, der 75 bis 300 mM Imidazol, einen sauren pH-Wert (pH 4 für Nickel-Agarosen und pH 6 für Cobalt-Agarosen) oder Nickel- oder Cobaltionen enthält. Störsubstanzen sind EDTA, manche Tenside und Reduktionsmittel (z. B. aus dem Probenpuffer). Nach der Elution wird das Imidazol meistens durch Dialyse oder Gelfiltration entfernt.
An die Nickel-basierten Säulenmaterialien bindet auch die Peptidyl-Prolyl-cis-trans-Isomerasen vom FKBP-Typ (SlyD, 25kDa) aus E. coli. Daher wird oftmals eine Tandem-Affinity-Purification zur weiteren Reinigung verwendet. Es gibt auch SlyD-defiziente Bakterienstämme. Cobalt-CMA-Agarose bindet SlyD schwächer.
Durch eine serielle Verwendung von mehreren Polyhistidin-Tags können Proteine mit zunehmender Anzahl bei zunehmender Imidazol-Konzentration nacheinander eluiert werden. Dadurch können mehrere Proteine mit unterschiedlicher Hexahistidin-Anzahl gleichzeitig gereinigt und bei steigenden Imidazol-Konzentrationen nacheinander eluiert werden.
Anwendungen
Polyhistidin-Tags werden zur Reinigung rekombinanter Proteine per Affinitätschromatographie, für Pulldown-Assays und – bei Verwendung von Anti-Polyhistidin-Tag-Antikörpern – für Methoden mit einer Immunmarkierung (z. B. ELISA, Western Blot, Immunfluoreszenz, Immunhistochemie und Durchflusszytometrie) verwendet. Es gibt selektiv bindende Fluoreszenzfarbstoffe. Ein Protein mit Polyhistidin-Tag kann auf Nickel- oder Cobalt-Oberflächen immobilisiert werden oder in Nickel-haltigen Membranen adsorbiert werden.
Einzelnachweise